缬氨酸限制性饮食可治疗肿瘤有了新证据
同济大学医学院/附属第十人民医院教授王平团队发现了一个全新的缬氨酸特异性感应器人源去乙酰化酶HDAC6,并揭示了缬氨酸限制导致HDAC6核转位,进而增强TET2活性并诱导DNA损伤的具体机制。11月20日,相关研究发表于《自然》。
机体如何感应氨基酸水平变化,并做出适应性反应是代谢应激与细胞命运的重要科学问题,探究氨基酸感应异常的分子机制,可能为预防或治疗代谢性疾病和癌症提供新靶标。作为一种必需的支链氨基酸,缬氨酸在蛋白质合成、神经行为、白血病进展中发挥着重要作用。然而,细胞感应缬氨酸的机制与功能尚不清楚。
研究团队发现,乙酰化酶HDAC6能够通过识别羧基端和侧链直接结合缬氨酸,且可以容忍氨基端修饰。而与缬氨酸结合的是HDAC6的SE14结构域。值得一提的是,该结构域仅在灵长动物的HDAC6中出现,鼠的HDAC6无法结合缬氨酸。
机制研究表明,细胞内缬氨酸匮乏时,将诱导HDAC6转位至细胞核,其酶活区域与DNA羟甲基化酶TET2的活性区域发生结合,促进TET2发生去乙酰化,酶活性被激活。研究团队进一步证实,细胞内缬氨酸饥饿能够通过HDAC6-TET2信号轴,促进DNA主动去甲基化。此外,缬氨酸匮乏诱导的DNA损伤也依赖于TDG切除氧化甲基胞嘧啶所产生的单链损伤。
值得一提的是,饮食限制或者靶向氨基酸代谢和感应已成为延长寿命和癌症等多种疾病治疗的辅助策略。为探究缬氨酸限制是否在癌症治疗中发挥作用,研究团队在结直肠癌异种移植瘤模型中进行了实验。结果表明,适宜的缬氨酸限制饮食可显著抑制肿瘤生长,同时副作用较小。在肿瘤样本中,缬氨酸水平的降低与HDAC6核易位、5hmC水平和DNA损伤程度的增加呈正相关。缬氨酸限制性饮食和PARP抑制剂talazoparib联合治疗可显著增强抗肿瘤效果,为该疗法通过诱导DNA损伤治疗癌症提供了有力证据。
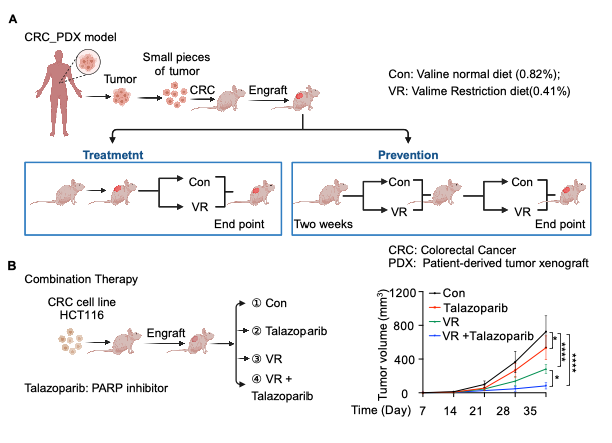
缬氨酸饮食抑制肿瘤发生与发展。图片由研究团队提供
相关论文信息:https://doi.org/10.1038/s41586-024-08248-5
